应用于肿瘤靶向药物递送的
还原响应性可降解聚合物
作者:张文龙 化学工程系
聂振宇 化学工程系
指导老师:和亚宁 化学工程系
关键词:肿瘤靶向治疗、可降解聚合物、还原响应性、基因载体
摘要
基因治疗是近年来一种新型的癌症治疗手段,从机理上可以克服很多传统治疗技术的缺点,具有针对性强、效果显著等优势。治疗基因可以通过基因编辑技术接在质粒DNA上,而递送DNA的载体还有待开发。本作品设计并合成了多种带正电荷的聚合物,可以成功包覆带负电荷的质粒DNA,并且能实现将带有治疗基因的质粒DNA靶向递送进肿瘤细胞同时成功释放出质粒DNA的功能,随后质粒DNA上的治疗基因被转录,从而达到基因治疗的目标。
偶氮聚合物体系
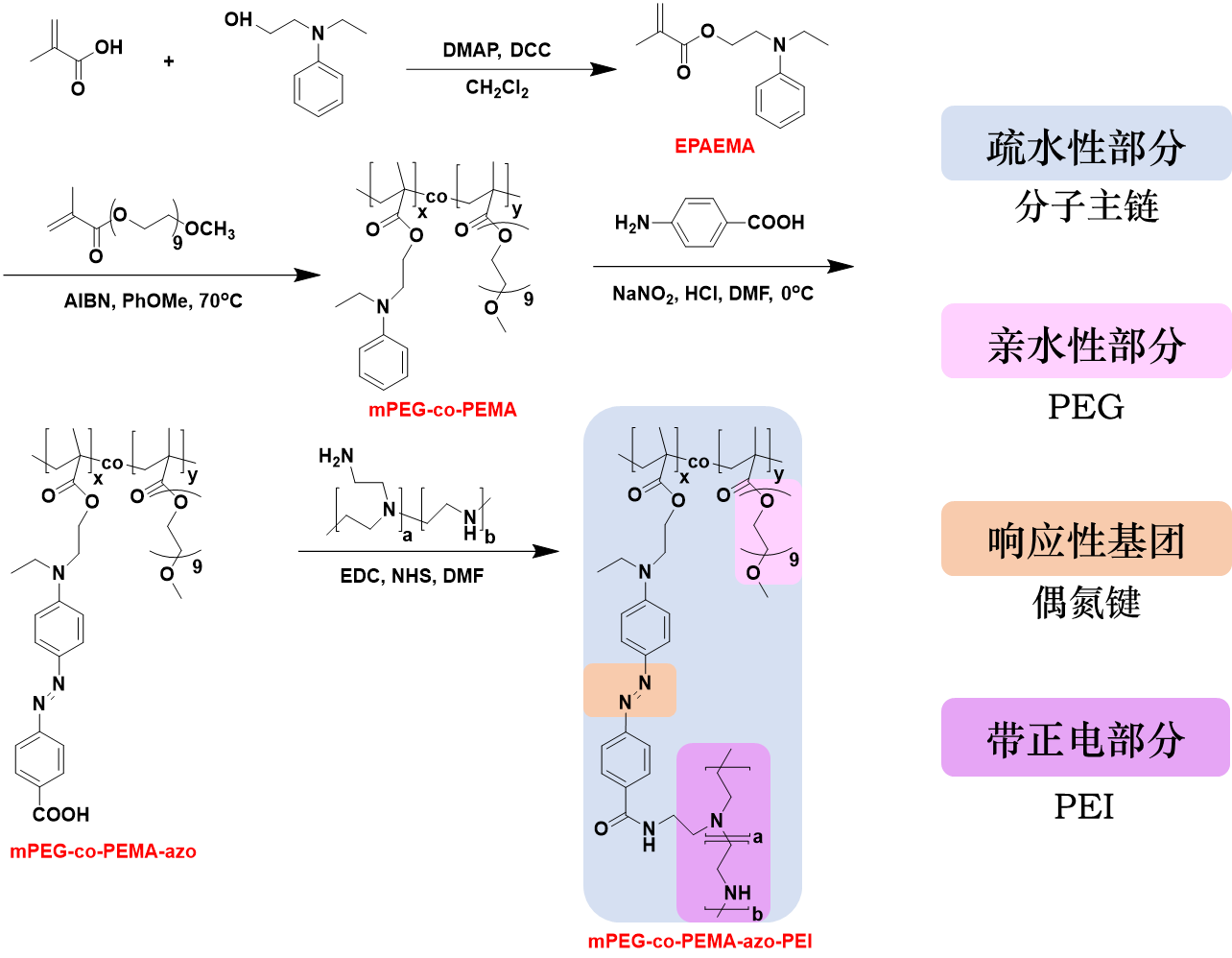
本作品所设计的偶氮聚合物为mPEG-co-PEMA-azo-PEI。结构中,PEG是亲水性部分,可以防止基因载体与体液中的蛋白相互作用,形成聚合物的保护层;PEI在体内水溶液环境下可以结合大量质子,使聚合物带有大量正电荷,然后再与带负电的质粒DNA通过静电相互作用结合形成复合物,复合物颗粒的半径约为200 nm。聚合物中的偶氮键对肿瘤组织的乏氧微环境十分敏感,可以在偶氮还原酶的作用下断裂,导致聚合物的分解,释放出质粒DNA,实现靶向递送和治疗的功能。凝胶电泳分析结果表明,我们设计的聚合物在氮磷比(N/P)大于2时可以成功包覆质粒DNA。
双硫聚合物体系
双硫聚合物与偶氮聚合物的设计思路相似,引入双硫键并采用二甲氨基作为质子载体,PEG片段与双硫键也使得聚合物具有很好的生物相容性和生物可降解性。肿瘤细胞内谷胱甘肽GSH的浓度远高于正常细胞,聚合物在肿瘤细胞内高浓度GSH的作用下被破坏,发生二硫键的还原断裂,释放出质粒DNA,从而起到靶向治疗的作用。
总结与展望
本作品设计了一系列聚合物结构用于包覆质粒DNA,DNA包覆成功后送入人体内,在肿瘤组织特殊微环境下,聚合物发生分解反应,从而达到释放治疗基因的目的。目前,高分子载体介导的基因治疗在癌症预防、早期诊断和治疗等领域已经进行了大量的临床研究试验,相信在不久的将来这一技术会成为一项推动医学革命性改变的新技术。
图1 偶氮类聚合物的合成路线与结构中各部分的功能

图2 对偶氮聚合物和质粒DNA的复合物进行凝胶电泳分析的结果。a: 分子量对照;b~f: N/P=0.25, 0.5, 1, 2, 4;g: pDNA

图3 偶氮聚合物包覆质粒DNA形成的微粒被偶氮还原酶降解并释放出DNA的过程
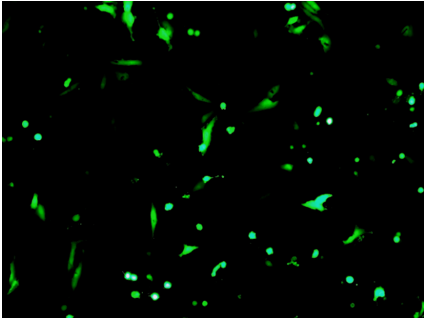
图4 PEI和质粒DNA的复合物(N/P = 10)可以在HeLa细胞中转录出绿色荧光蛋白
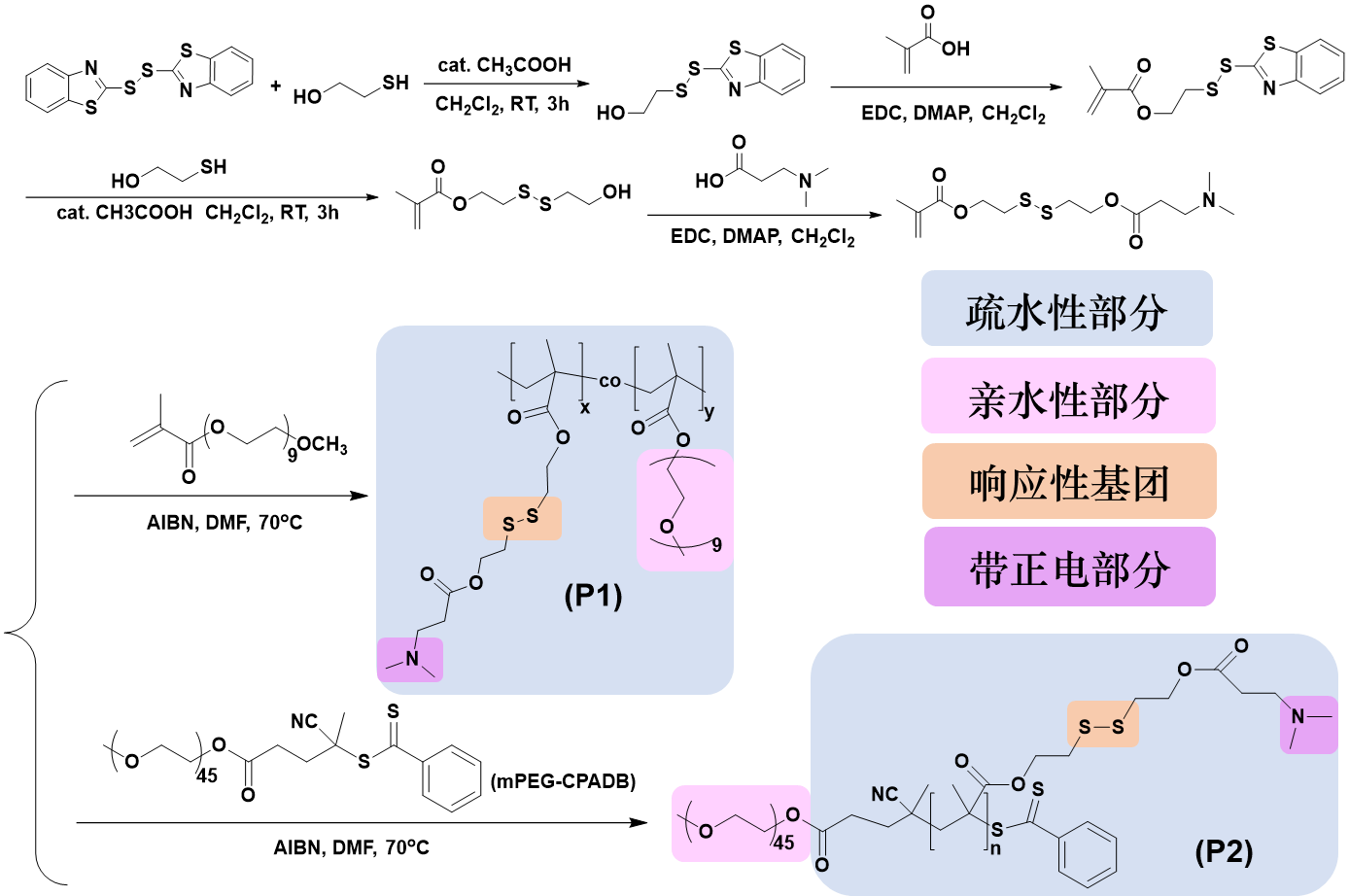
图5 侧链型双硫聚合物的合成路线与结构中各部分的功能







