作者:2017级本科生 王鸿奎 化工系
指导老师:卢元 化工系
关键词:无细胞体系 MOFs 微流控 调节
摘要
无细胞体系因为其个性化设计、易于调控、对毒性不敏感等优点在合成生物学领域迅速发展起来,但就目前来看,大多数应用仍停留在开放体系的层面,没有摆脱传统培养模式的束缚,这也进一步限制了其向更多领域的渗透。本文旨在结合新材料金属有机框架(Metal organic frameworks, MOFs)及微流控技术来探讨调节无细胞体系蛋白质表达水平的基本方法,以求拓宽其的适应性,努力就其与其他领域的交叉和应用提供可能。
引言
近年来,材料科学突飞猛进,诸多成果数不胜数,其中最引人注目之一的便是MOFs。作为一种新型材料,其具有极高的孔隙率、巨大的比表面积、良好的化学稳定性、结构的可调控性等诸多优点,本文主要是利用其包覆作用来实现限域和减小传质速率的目的。同时,从水凝胶的应用得到启发,了解了微流控“极高的传热、传质速率,较高的表面效应、易于调控液体大小”等优点,利用了微流控可产生和改变液滴大小的功能探索了油包水结构以及液滴大小对整个无细胞体系的影响。
实验方法
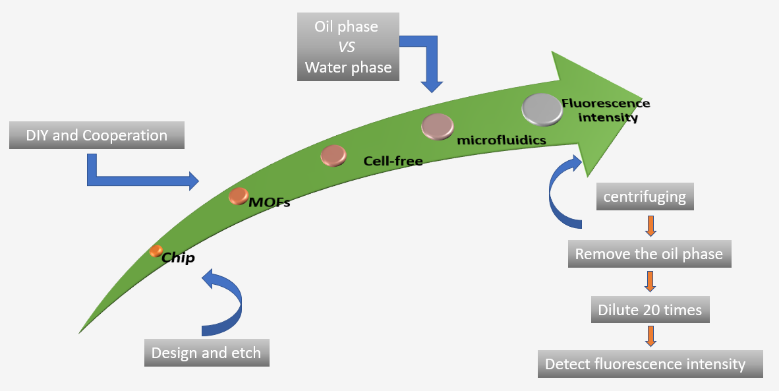
图1 整体实验流程图解
如图1所示,本实验整体分五步进行,分别为:微流控芯片的设计和制备(模型见图2)、MOFs材料的合成(见图3)、无细胞体系的制备(见图4)、微流控芯片的应用、培养及荧光表征。
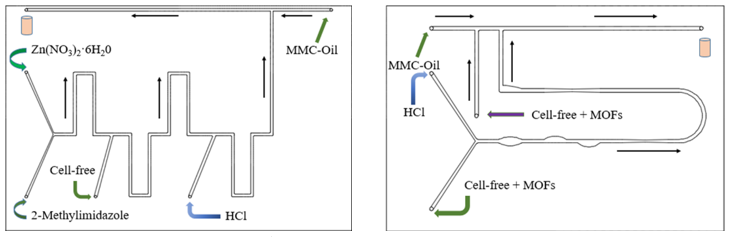
图2 微流控芯片模型
如图2所示,本实验设计了两款芯片,主要是考虑流道结构对流体混合和调控的影响,可产生体积为 以下的微液滴。
以下的微液滴。
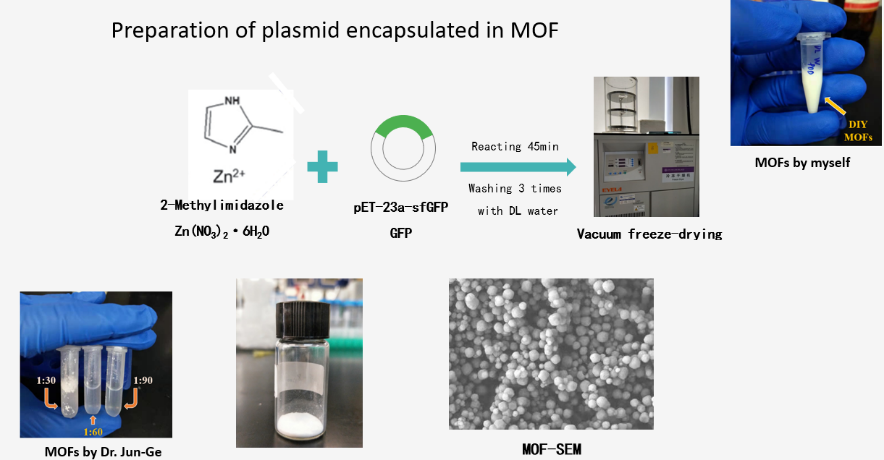
图3 MOFs材料的合成
如图3所示,本实验基于MOFs材料ZIF-8的经典合成路线,分别尝试了冷冻干燥和非冷冻干燥两种模式,探讨对无细胞体系表达的影响。
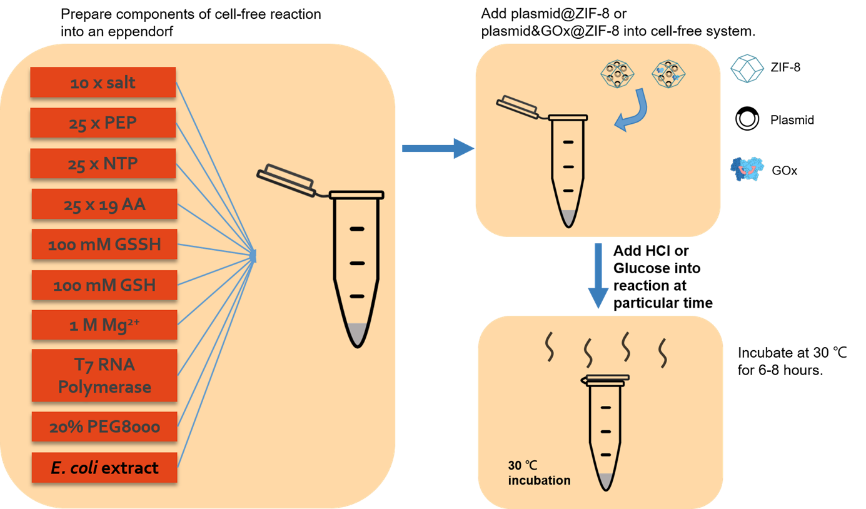
图4 无细胞体系的制备
如图4所示,用经过优化的无细胞体系材料制备无细胞体系,才有荧光蛋白作为报告物质,用酶标仪对其后期荧光强度做定量检测。
实验结果讨论
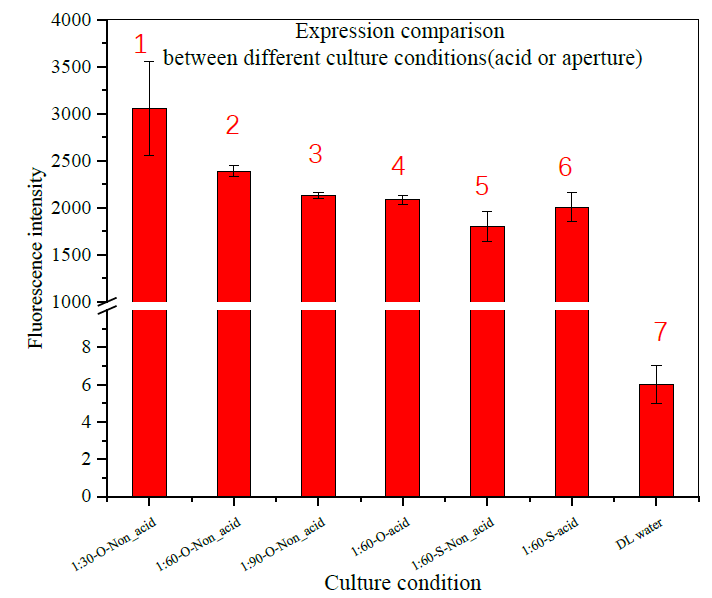
图5 不同培养环境下蛋白质表达水平对比(其中O表示已水洗,S表示未水洗)
图5表示的是MOFs孔径大小、加酸、配体离子浓度对荧光蛋白表达的影响(液滴体积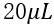 )。通过比较,可知:(1)MOFs的孔径大小对无细胞体系表达水平有一定影响,具体表现在随着MOFs孔径的增大,表达水平也提高;(2)游离的配体离子可能对无细胞体系有较强的毒性作用,且毒性强弱与离子浓度成正相关;(3)加酸与否也会影响蛋白质的整体表达。
)。通过比较,可知:(1)MOFs的孔径大小对无细胞体系表达水平有一定影响,具体表现在随着MOFs孔径的增大,表达水平也提高;(2)游离的配体离子可能对无细胞体系有较强的毒性作用,且毒性强弱与离子浓度成正相关;(3)加酸与否也会影响蛋白质的整体表达。
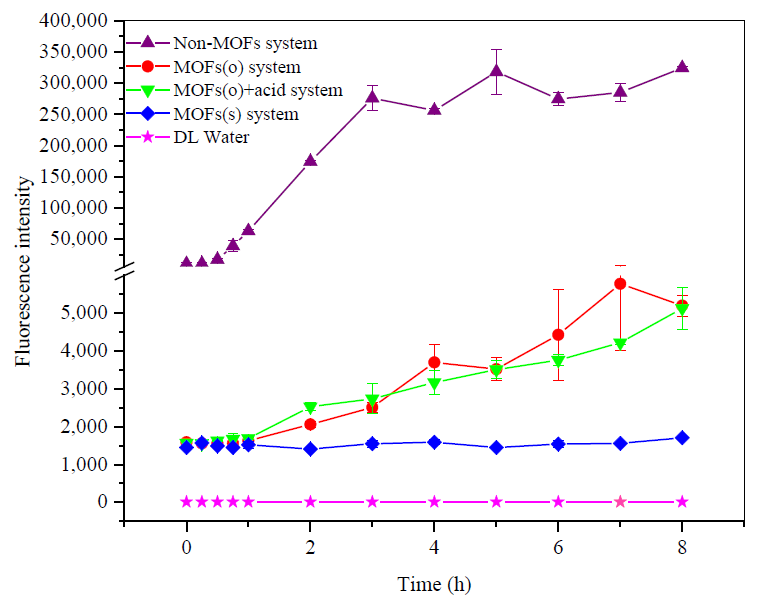
图6 不同培养环境下蛋白质表达时间曲线
为了进一步验证图5中分析出的诸多影响因素及其内部原因,本实验做了系列实验,并绘制出了不同培养环境下的蛋白质表达时间曲线,结果如图6所示。
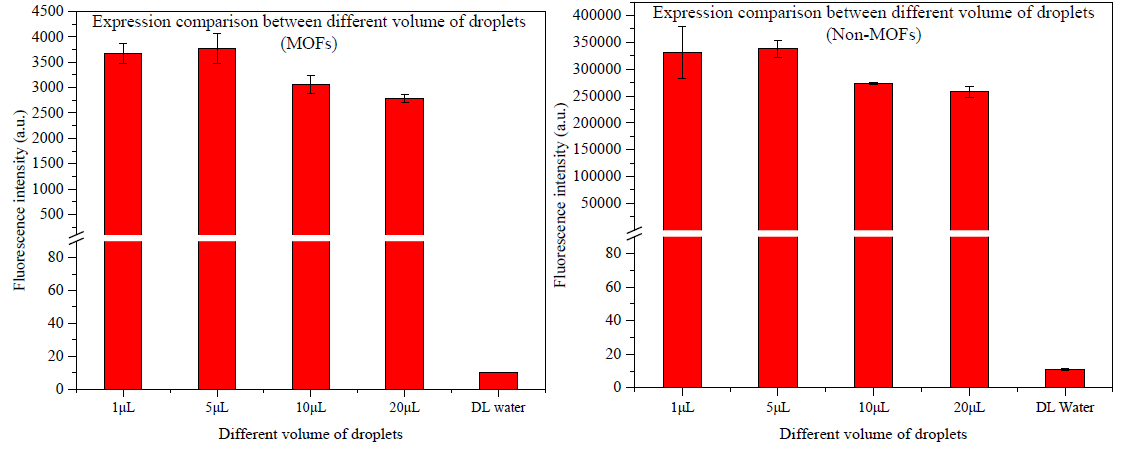
图7 不同液滴大小下蛋白质表达对比(含MOFs -不含MOFs)
为进一步探讨液滴大小对蛋白质表达的影响,本实验结合设计的两款芯片,形成了不同大小的液滴,并在含有MOFs和不含有MOFs两个不同体系下进行了相应地荧光表征,结果如图7所示。从结果中我们可以明显的发现,在不同的体系下,蛋白质的表达水平随液滴大小的变化水平呈现相同的趋势,表现出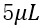 在实验梯度范围内局部最优的状态;此结果表明,液滴的大小确实对蛋白质的表达水平有一定影响,但其影响效果成峰形分布,这意味着不同液滴大小中影响因素不单一。
在实验梯度范围内局部最优的状态;此结果表明,液滴的大小确实对蛋白质的表达水平有一定影响,但其影响效果成峰形分布,这意味着不同液滴大小中影响因素不单一。
结论
本研究主要基于新材料MOFs 和微流控技术,探讨了影响蛋白质表达的诸多因素,并总结归纳相关因素,提出相应的调控蛋白质表达水平行之有效的办法:改变MOFs孔径大小、调节酸性物质含量、控制游离配体离子浓度、调节氧含量、改变液滴大小等。但由于整个实验设计试剂众多,培养环境多变,蛋白质表达呈现出了高度的综合性,了解清楚每一个因素的影响趋势及每一个实验现象背后的科学依据,需要一定的时间,也从侧面反映了实际体系的复杂性。






